在現代藥物研發(fā)中,糖類(lèi)化合物的作用日益受到重視。作為生物大分子之一,糖類(lèi)化合物在細胞識別、信號傳遞和免疫反應中扮演著(zhù)關(guān)鍵角色。然而,由于其復雜的結構和多樣的功能,糖類(lèi)化合物的合成和修飾一直是有機化學(xué)和藥物化學(xué)中的一大挑戰。
傳統的化學(xué)合成方法往往難以實(shí)現對糖類(lèi)化合物結構的精確控制,這限制了其在藥物設計中的應用。因此,科學(xué)家們一直在尋求更為高效和選擇性的合成策略,以便能夠在不破壞其活性的前提下,對糖類(lèi)化合物進(jìn)行定向修飾。
中國科學(xué)院成都生物研究所馬小鋒課題組在此背景下,一直致力于溫和條件下多樣化糖苷類(lèi)化合物的合成方法學(xué)與生物活性方面的研究工作(Org. Lett. 2024,26,1332; Molecules 2023,28,4724;Carbohydr. Res. 2023,108902;Chem. Asian J. 2022,17,e202200120; J. Org. Chem. 2022,87,16736)。近期,通過(guò)創(chuàng )新的氫鍵催化策略,成功開(kāi)發(fā)了一種基于硝基烯糖的新型C3官能團化和C1,C3-雙官能團化反應方法。這一方法可以在室溫條件下,高效、高選擇性(包括立體選擇性和區域選擇性)地合成一系列C1,C3-雙吲哚或吡咯取代,以及C1-吲哚-C3吡咯-、C1-吡咯-C3吲哚-取代的糖衍生物,為糖類(lèi)化合物的合成和修飾提供了新的可能性(圖1)。經(jīng)初步生物活性評價(jià)表明,部分化合物具有較強的抗腫瘤活性,并對人體正常肝細胞呈現較低的細胞毒性,具有成為高效、低毒的新型抗腫瘤先導化合物的潛力。
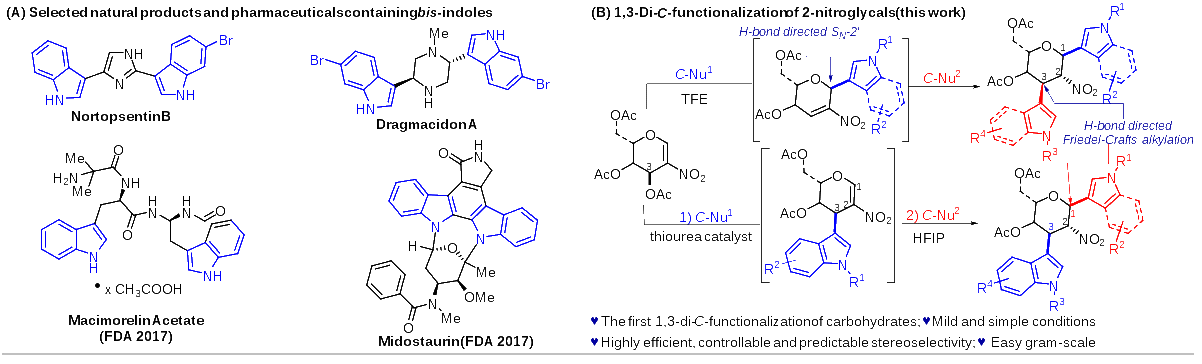
圖1. 含雙吲哚的活性分子以及C1,C3雙吲哚糖衍生物的合成新方法
作者通過(guò)一系列條件篩選發(fā)現,以2,2,2-三氟乙醇(TFE)為溶劑和促進(jìn)劑,在分子篩(MS)存在下,2-硝基稀糖和吲哚在室溫下反應,以單一的非對映體形成了C1,C3-雙吲哚化取代的糖衍生物3a,分離收率為92%。作者隨后在該反應條件下,考察了不同取代吲哚和吡咯對全乙酰基硝基葡萄糖的反應性(圖2):N-甲基保護的含有不同取代基的吲哚和吡咯以高收率和單一選擇性得到產(chǎn)物,且吲哚取代基較為豐富,包括氯、溴、甲基、甲氧基、芐氧基和炔丙氧基等取代基;當以N-原子未保護的吲哚為原料時(shí),該反應也可以順利發(fā)生,但立體選擇性有所降低,可能是由于TFE、C2-NO2和吲哚的N-H之間的多重氫鍵相互作用所致。
隨后,作者考察了不同的2-硝基烯糖與吲哚的反應性:對于產(chǎn)物4a來(lái)說(shuō),該反應在克級規模時(shí),也能順利發(fā)生,產(chǎn)率略有降低但對選擇性無(wú)明顯影響;此外,作者也發(fā)現,通過(guò)C3-OAc的立體化學(xué),可以預測產(chǎn)物中端基碳的立體化學(xué),比如當以C3-位具有豎健(a-鍵)的OAc的硝基烯糖1a為原料時(shí),產(chǎn)物3a中的端基碳也處于豎鍵的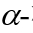 構型;相反,當以C3-位具有橫鍵(e-鍵)的OAc的硝基烯糖1b為原料時(shí),產(chǎn)物4a中的端基碳也處于橫鍵的
構型;相反,當以C3-位具有橫鍵(e-鍵)的OAc的硝基烯糖1b為原料時(shí),產(chǎn)物4a中的端基碳也處于橫鍵的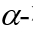 構型,而C2和C3位置的立體化學(xué)不受影響。其它常見(jiàn)乙酰化半乳糖硝基烯糖、乙酰化鼠李糖硝基烯糖等也均能以不錯的收率和單一選擇性得到相應產(chǎn)物,乳糖這類(lèi)二糖的硝基烯糖也能在該條件下完成轉化。
構型,而C2和C3位置的立體化學(xué)不受影響。其它常見(jiàn)乙酰化半乳糖硝基烯糖、乙酰化鼠李糖硝基烯糖等也均能以不錯的收率和單一選擇性得到相應產(chǎn)物,乳糖這類(lèi)二糖的硝基烯糖也能在該條件下完成轉化。
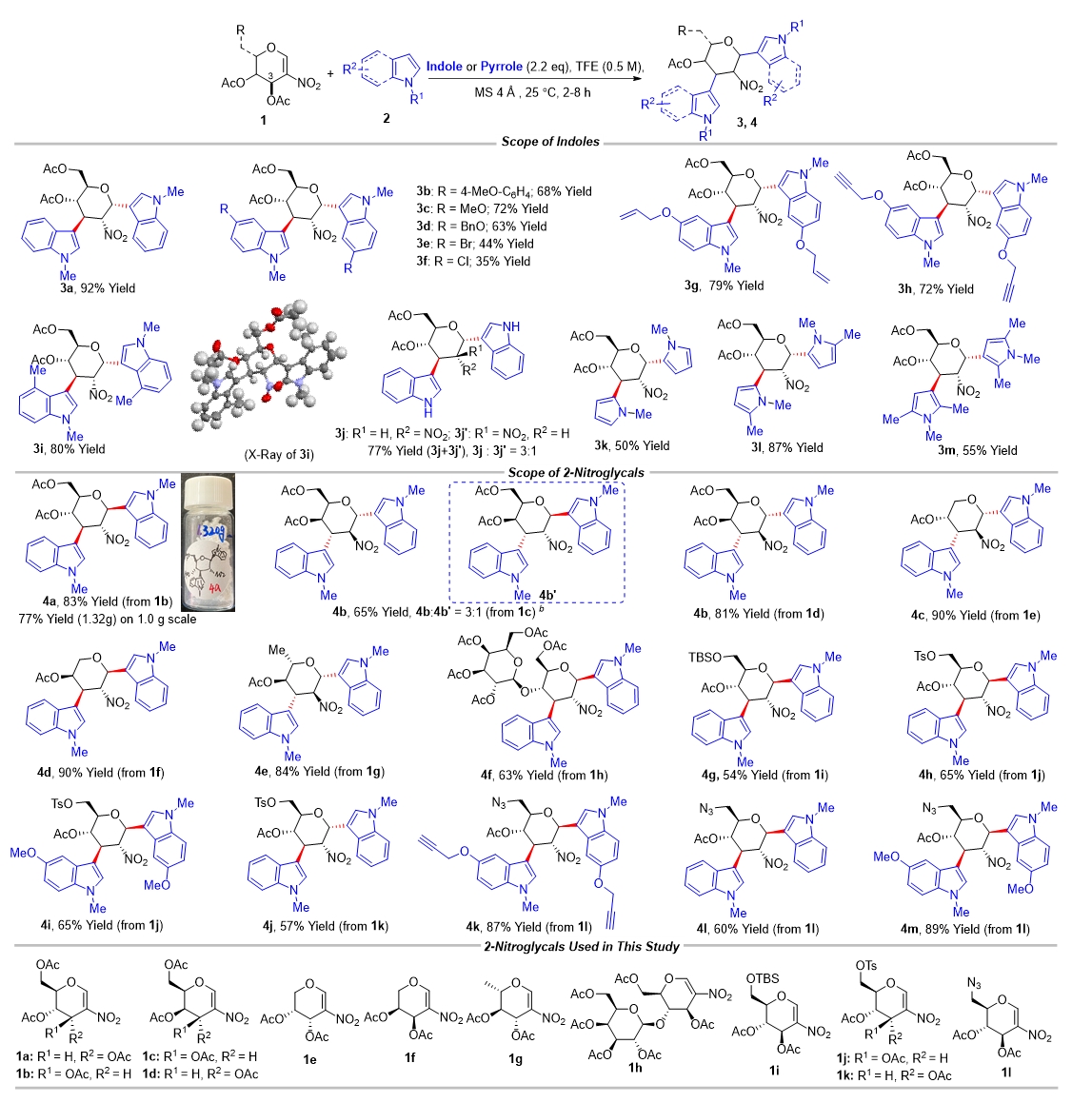
圖2 2-硝基烯糖的C1,C3-雙官能團化底物范圍
作者在考察反應底物范圍時(shí)發(fā)現,降低反應溫度和減少吲哚的用量,可以分離得到Ferrier重排的2-硝基-吲哚-C-苷中間體,該中間體可以進(jìn)一步在另一分子吲哚存在時(shí),在室溫到50 °C的反應溫度下,發(fā)生Michael加成反應,形成C1和C3位置不同吲哚取代的糖衍生物。基于此策略,作者通過(guò)使用不同取代基的吲哚以及不同的硝基烯糖(除乙酰化的半乳糖硝基烯糖以外),采用兩步一鍋法,合成得到了系列C1和C3位置不同吲哚取代的糖衍生物,并獲得了較高的產(chǎn)率、優(yōu)秀的立體選擇性和區域選擇性,且可以以良好收率進(jìn)行克級反應(圖3)。
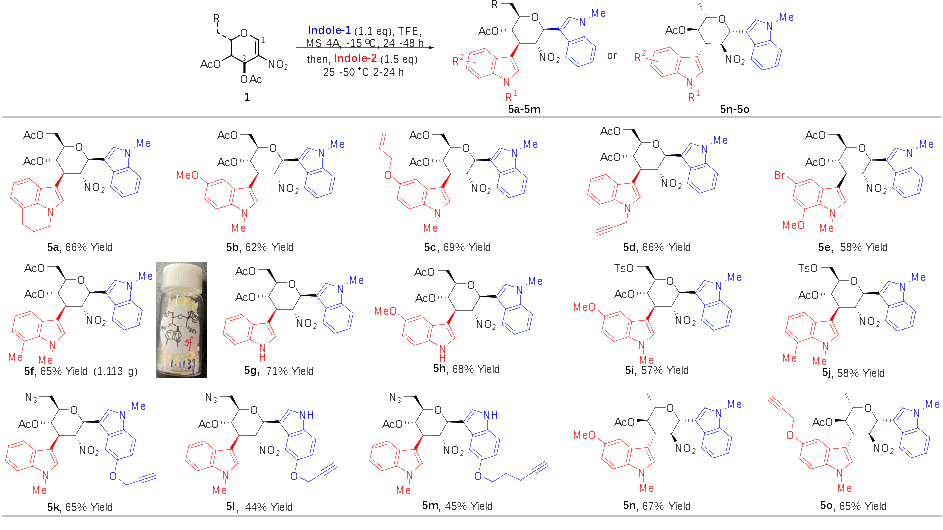
圖3 C1和C3位置不同吲哚的C1,C3-雙吲哚化糖苷的制備
由于作者無(wú)法通過(guò)上述圖3的方法,高立體選擇性地合成C1和C3位置不同吲哚取代的半乳糖衍生物,為了改變這一困境,作者通過(guò)優(yōu)化反應條件,發(fā)現以雙功能硫脲為催化劑時(shí),可以以較高收率、高立體選擇性和高區域選擇性得到C3吲哚取代的2-硝基半乳糖烯糖。并且該反應底物范圍廣泛,不同位置單取代吲哚、多取代吲哚、吡咯均可以適用于該反應。為了比較,作者也發(fā)現,其它硝基烯糖也可以應用到該反應中,得到C3吲哚取代的2-硝基烯糖(圖4)。
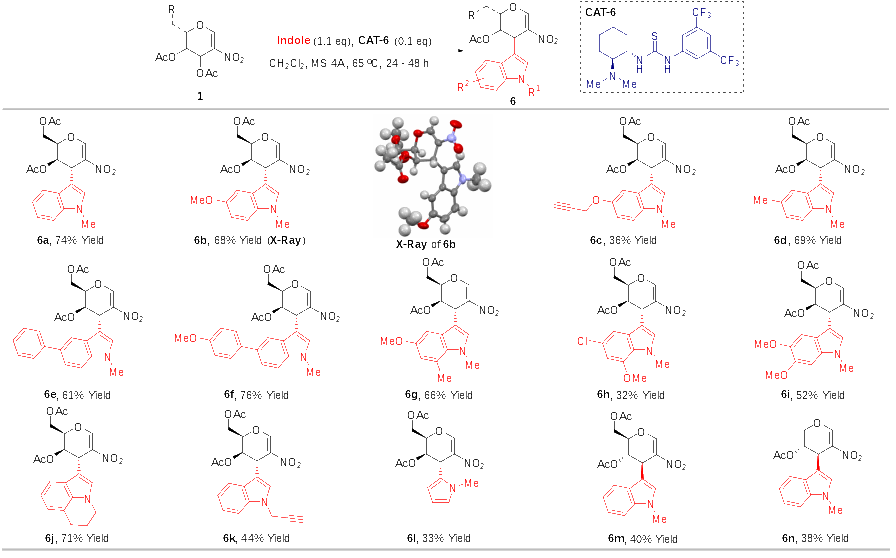
圖4 3-吲哚-2硝基烯糖的制備
隨后,作者以C3吲哚取代的2-硝基烯糖6為原料,以1,1,1,3,3,3-六氟異丙醇(HFIP)為溶劑,在4 ?分子篩存在的條件下,成功地使6與另一分子吲哚或吡咯反應,合成了系列C1,C3-雙吲哚取代、C3-吲哚-C1-吡咯取代的半乳糖衍生物(圖5)。作者發(fā)現,在合成C1,C3-雙吲哚取代的半乳糖衍生物時(shí),該反應非對映選擇性較差(圖4,4a,7b-7d),但是在合成C3-吲哚-C1-吡咯取代的半乳糖衍生物時(shí)(7a),該反應具有很高的非對映選擇性,在其它糖的C3-吲哚-C2-硝基烯糖的底物中,作者發(fā)現了類(lèi)似的現象。
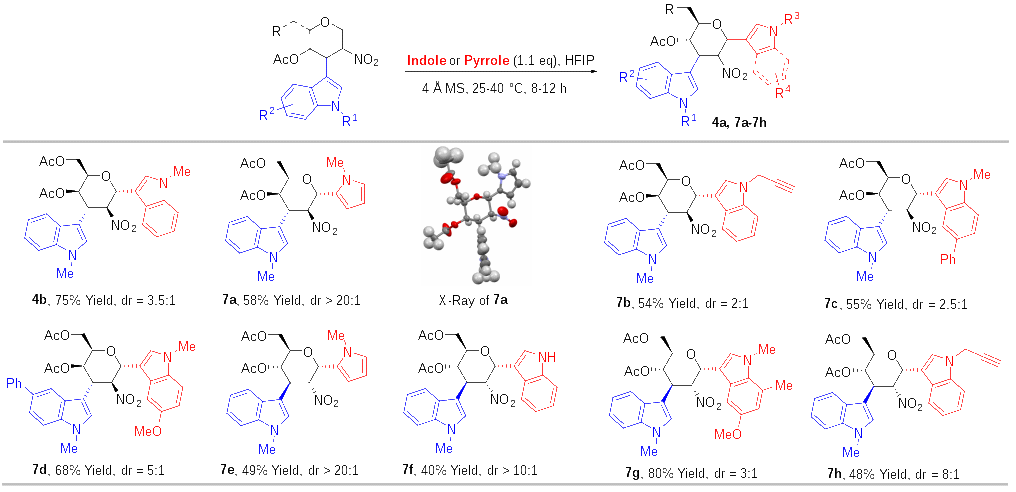
圖5 從C3-吲哚硝基烯糖合成C1,C3-雙取代糖衍生物
最后,作者也對該反應的產(chǎn)物進(jìn)行了一些簡(jiǎn)單的衍生化(圖6)。產(chǎn)物中的硝基,可以經(jīng)雷尼Ni催化還原,并原位保護,轉化為2-磺酰胺基吲哚糖衍生物(9),而乙酰基可以在堿存在下,高效地脫除形成糖衍生物10。同時(shí),由于部分產(chǎn)物中,既含有N3基團,又含有炔基,因此,在Click反應條件下,作者成功地合成了系列糖橋環(huán)大環(huán)類(lèi)化合物(11-13)。而且,C1-吲哚-C2-硝基烯糖,也可以在TFE中,與吡咯反應,高效、高立體選擇性地合成C1-吲哚-C3-吡咯糖衍生物,進(jìn)一步展現出了該方法在合成1,3-雙-C-取代的糖衍生物方面的巨大潛力。最后,作者也對所獲得的部分化合物進(jìn)行了活性評估,結果表明,部分C1-吲哚-C2-硝基烯糖如8a,8b對HCT 116(人結腸癌細胞)的細胞毒活性IC50分別為1.586 μM 和 1.134 μM,對T24人膀胱癌細胞的細胞毒活性IC50 分別為2.949 μM和 3.548 μM,對AGS(人胃腺癌細胞) 的細胞毒活性IC50分別為0.695 μM 和 0.764 μM,同時(shí),大環(huán)類(lèi)化合物11表現出選擇性地對MKN-45(人胃腺癌細胞)的細胞毒活性IC50為2.416 μM。
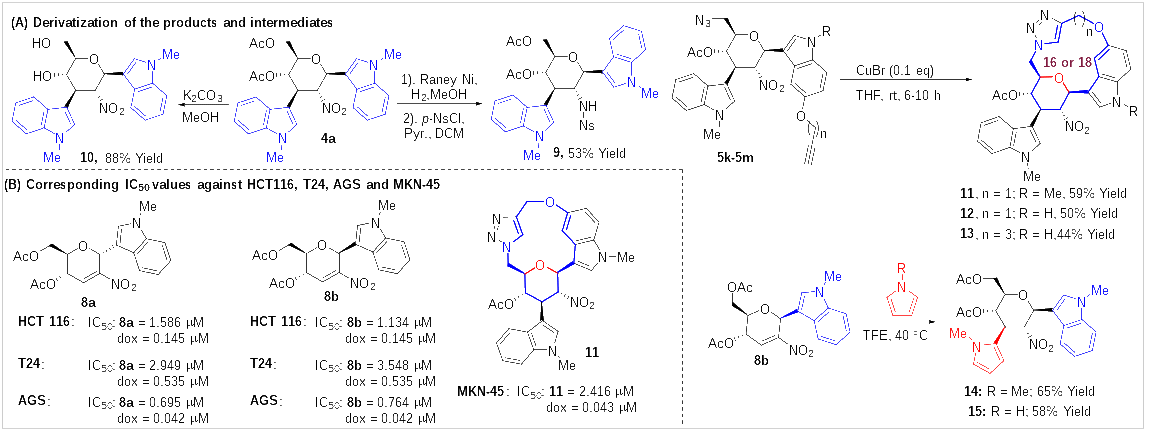
圖6 產(chǎn)物的衍生化及部分化合物的活性評估
總之,中國科學(xué)院成都生物研究所馬小鋒研究員與其合作者報道了一種室溫下,氟代醇溶劑(TFE)促進(jìn)的、高效、高立體選擇性的2-硝基糖的1,3-雙-C-官能化反應。所需的硝基烯糖可以從烯糖經(jīng)一步反應大規模制備,這為傳統方法無(wú)法獲得的 C1,C3-雙-吲哚-、C1,C3-雙吡咯-取代的糖衍生物提供了直接有效的合成方法。此外,通過(guò)C3位乙酰基的立體化學(xué),可以預測反應產(chǎn)物中端基碳的α-或β-立體選擇性;同時(shí),通過(guò)對反應條件細微的改變,可以實(shí)現在糖的C1和C3位置上引入兩種不同的吲哚;最后,當利用硫脲為催化劑時(shí),能選擇性地合成C3-吲哚取代-C2-硝基烯糖,其可以進(jìn)一步在C1位發(fā)生官能團化修飾。結合這三種策略,作者高效、高立體選擇性地制備了一系列具有挑戰性的C1,C3-雙-吲哚-、C1,C3-雙吡咯-、C1-吲哚-C3吡咯-、C1-吡咯-C3吲哚-取代的糖衍生物。生物活性評價(jià)表明,3個(gè)化合物對T24、HCT116、AGS和MKN-45細胞具有較強的抗腫瘤活性,IC50在0.695 ~ 3.548 μM之間,而對人正常肝細胞(L-02)具有較低的細胞毒性,這將有利于高效、低毒的新型抗腫瘤化合物的進(jìn)一步研發(fā)。
該研究以“Controllable 1,3-Bis-Functionalization of 2?Nitroglycals with High Regioselectivity and Stereoselectivity Enabled by a H?Bond Catalyst”為題發(fā)表于JACS Au(JACS Au2024,4,974?984)。中國科學(xué)院成都生物研究所馬小鋒研究員為本文的通訊作者,博士研究生李江濤為文章第一作者。同時(shí),與該研究相關(guān)的內容已經(jīng)申請中國發(fā)明專(zhuān)利四項(一種3-吲哚或吡咯基-2-硝基烯糖類(lèi)化合物及其制備方法與應用,專(zhuān)利申請號:202410059158.X;一種2-硝基-2-烯吲哚糖碳苷類(lèi)化合物及其合成方法與應用,專(zhuān)利申請號:202310766858.8,一種吲哚糖碳苷類(lèi)大環(huán)化合物及其制備方法與應用,專(zhuān)利申請號:202310691698.5;吲哚糖苷類(lèi)化合物及吡咯糖苷類(lèi)化合物及合成方法與應用。專(zhuān)利申請號:202211581675.0)。上述研究得到國家自然科學(xué)基金(22377123、22001246)、四川省科技計劃項目(2022ZYD0047、2022JDRC0132)、中國科學(xué)院生物資源計劃(KFJBRP-008)的支持。
