智能化的可控釋放納米遞藥體系可以對諸如pH、溫度、光照、氧化劑、酶以及超聲輻照等外界的環(huán)境的刺激做出反饋性響應(yīng),以其優(yōu)異的控制釋放功能而在藥物傳輸體系中表現(xiàn)出極具前景的潛在應(yīng)用。其可針對腫瘤細(xì)胞與正常組織的生物學(xué)差異選擇性釋藥,有效地降低了抗腫瘤藥物對正常細(xì)胞的毒副作用,大大提高藥物的利用率。但是,由于腫瘤組織及細(xì)胞的環(huán)境復(fù)雜性,單一的刺激模式或者簡單的功能輸出已經(jīng)不能滿足日新月異的聚合物材料的需求. 因此發(fā)展更新型的刺激條件、多元化的刺激方式和具有邏輯控制特點的功能響應(yīng)已經(jīng)成為構(gòu)筑刺激響應(yīng)性聚合物體系的難點與熱點。
中科院成都生物所李幫經(jīng)研究員課題組長期致力于基于環(huán)糊精主客體識別作用來構(gòu)筑智能納米遞藥系統(tǒng)。針對腫瘤細(xì)胞內(nèi)存在的高濃度谷胱甘肽(GSH)及酸性環(huán)境特性,該課題組利用環(huán)糊精修飾的天然多糖透明質(zhì)酸和金剛烷修飾的抗癌藥物喜樹堿(ADA-CPT),通過環(huán)糊精與金剛烷的特異性主客體識別作用,簡單高效地構(gòu)筑了一類雙重腫瘤微環(huán)境刺激響應(yīng)性的納米遞藥體系。當(dāng)納米藥物載體通過腫瘤組織的EPR作用富集在腫瘤組織中,并進(jìn)一步被腫瘤細(xì)胞內(nèi)吞后,腫瘤細(xì)胞內(nèi)的酸性環(huán)境將環(huán)糊精與透明質(zhì)酸相連的pH敏感的亞胺鍵破壞,釋放出環(huán)糊精與金剛烷的包合物(β-CD/ ADA-CPT),并形成粒徑更小的載藥納米體;同時,在高濃度的GSH環(huán)境存在下,ADA-CPT分子中的雙硫鍵結(jié)構(gòu)破壞,并進(jìn)一步釋放出抗癌藥物CPT,實現(xiàn)對腫瘤細(xì)胞的殺滅作用,如圖1所示。通過利用腫瘤細(xì)胞內(nèi)的酸性環(huán)境及高濃度GSH環(huán)境,該雙重刺激響應(yīng)性的納米遞藥體系還可以實現(xiàn)抗癌藥物的分步按需釋放,提供更為靈巧的控制釋放性能。
相關(guān)文章發(fā)表在期刊Polymer Chemistry 上,(pH, glutathione dual-triggered supramolecular assemblies as synergistic and controlled drug release carrier. Polymer Chemistry, 2017, DOI: 10.1039/C7PY01644A)。論文的第一作者為中科院成都生物所助理研究員康洋。
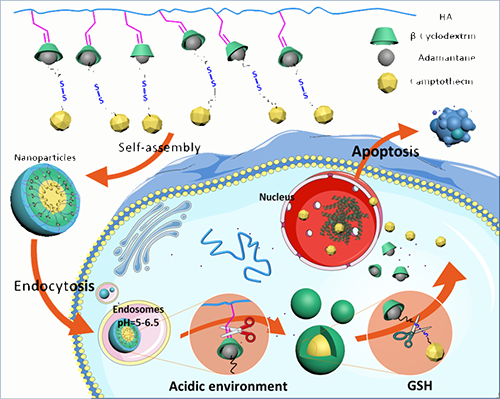
圖一.pH, GSH雙重刺激響應(yīng)性納米藥物載體的自組裝及腫瘤細(xì)胞內(nèi)釋藥示意圖。
